Перейти к:
Развитие новых технологий защиты рыб от инфекций в условиях аквакультуры
https://doi.org/10.21443/3034-1434-2024-2-3-64-82
Аннотация
Интенсивное развитие аквакультуры ведет к нарастанию экологических проблем, среди которых наибольшую угрозу водной среде представляют распространение инфекционных заболеваний, а также использование антибиотиков и ряда противомикробных препаратов. Антибиотики используются во всех направлениях аквакультуры, и при этом возникает проблема загрязнения антибиотиками окружающей среды.
Новые технологии борьбы с болезнями рыб в условиях аквакультуры, основанные на вакцинации объектов культивирования, используются для того, чтобы заменить широко распространенное использование антибиотиков, отрегулировать баланс микробной среды в аквакультуре и в итоге избежать воздействия остатков лекарственных препаратов на здоровье человека.
Целью данного исследования является изучение молекулярных механизмов иммунного ответа организма рыб на вирусную инфекцию. Получены данные по изменению уровня экспрессии генов в различных органах рыб по мере развития болезни. Результаты исследования могут быть использованы при разработке вакцины против вибриоза, что поможет избежать применения большого количества антибиотиков, которые наносят ущерб среде обитания рыб и, как следствие, здоровью человека.
Ключевые слова
Для цитирования:
Дун С., Шилин М.Б., Леонтьева Е.О. Развитие новых технологий защиты рыб от инфекций в условиях аквакультуры. Арктика и инновации. 2024;2(3):64-82. https://doi.org/10.21443/3034-1434-2024-2-3-64-82
For citation:
Dong X., Shilin M.B., Leonteva E.O. Development of improved technologies for protecting fish from infections in aquaculture. Arctic and Innovations. 2024;2(3):64-82. (In Russ.) https://doi.org/10.21443/3034-1434-2024-2-3-64-82
Актуальность темы исследований
В условиях нарастающей антропогенной нагрузки на водные экосистемы роль аквакультуры как неотъемлемой части мирового хозяйства становится все более значимой. Традиционно велика и постоянно возрастает роль аквакультуры в странах, обладающих достаточным запасом морских и пресноводных водоемов, пригодных для ее развития, таких как Россия и Китай [1].
Известно, что физиология и экология морских и пресноводных гидробионтов резко различаются [2–5]. Соответственно, существенны различия организации аквакультуры в морских и пресных водоемах. Это позволяет в качестве двух основных направлений аквакультуры выделять марикультуру — выращивание гидробионтов в морских водах — и лимнокультуру — культивирование пресноводных гидробионтов [2].
С появлением интенсивных промышленных рыбных хозяйств появились и проблемы, связанные с инфекционными заболеваниями рыб, которые наносят существенный вред рыбным хозяйствам и аквакультурному сектору мировой экономики в целом [1].
В проведенном исследовании проблема рассмотрена на примере двух важных объектов культивирования в Евразийском регионе, в том числе в условиях Крайнего Севера и Арктики — большого желтого горбыля и радужной форели.
Большой желтый горбыль (Larimichthys crocea, Sciaenidae) — рыба семейства горбылевых, один из основных объектов марикультуры прибрежных вод Китая. По мере расширения масштабов выращивания большого желтого горбыля растет необходимость защиты этого объекта аквакультуры от инфекций. Для большого желтого горбыля в культуре опасность представляют, в частности, бактериальные заболевания, возбудителями которых являются Vibrio anguillarum и Vibrio harveyi, в настоящее время серьезно ограничивающие развитие аквакультуры большого желтого горбыля.
Радужная форель (Oncorhynchus mykiss, Salmonidae) — холодноводная рыба семейства лососевых, один из основных объектов лимнокультуры в России (преимущественно в северных регионах). Она также подвержена бактериальным, вирусным и паразитарным заболеваниям. Патогенная бактерия Aeromonas salmonicida, вызывающая аэромоноз, является для радужной форели наиболее распространенной инфекцией, которая может приводить к большим экономическим потерям.
Для эффективной борьбы против подобных патогенов в настоящее время широко применяются препараты с мощным противобактериальным действием, однако их постепенное накопление в водной среде и в объектах культивирования наносит вред водной среде и здоровью человека при употреблении в пищу рыбопродуктов, перенасыщенных антибиотиками.
Чтобы минимизировать этот вред, необходима разработка экологически безопасных методов профилактики и лечения бактериальных болезней рыб. Это, в свою очередь, требует расширения наших знаний о фундаментальных основах противобактериального иммунитета культивируемых видов.
Данные основы включают в себя изучение противовоспалительных белков иммунной системы рыб. В связи с малой изученностью белков иммунного ответа у рыб, особенно у аквакультурных видов, мы считаем, что исследования модели заражения типичными для аквакультурных объектов инфекциями являются одним из важных начальных шагов в разработке новых подходов к их лечению и профилактике. Такими белками, например, являются хемокины (CCL) и маннозные рецепторы (MRC). Эти белки играют центральную роль в организме рыб и выполняют ключевые функции: от связывания патогенов до клеточного сигналинга в различных провоспалительных процессах [6][7].
В настоящем исследовании на основе собранных новых данных по изучению активации этих генов у двух аквакультурных видов рыб в ответ на бактериальные инфекции мы разрабатываем преемственность моделей в обеспечении дальнейшего их тестирования для определения эффективности будущих новых биологически активных компонентов, укрепляющих их иммунитет [8]. Целью данного исследования является изучение на молекулярном уровне реакций специфического иммунного ответа важных аквакультурных видов рыб Китая и России L. crocea и O. mykiss в моделях их распространенных инфекционных заболеваний.
Для достижения цели работы были поставлены следующие задачи: установить особенности и взаимосвязи «структура–функция» in silico первичных и пространственных структур хемокинов CCL2, CCL3, CCL4, а также маннозных рецепторов MRC1 и MRC2 коммерчески важных промысловых и культивируемых видов рыб Китая (L. crocea) и России (O. mykiss); создать in vivo модели вибриоза L. crocea и аэромоноза O. mykiss в условиях аквакультуры; изучить уровни и локализацию экспрессии генов специфического иммунного ответа на примере хемокинов CCL2, CCL3, CCL4 в норме и в модели вибриоза L. crocea; соотнести локализацию и уровни экспрессии генов неспецифического иммунного ответа на примере маннозных рецепторов MRC1, MRC2 в созданных моделях патологий.
Для выполнения запланированного исследования использовали два взаимодополняющих методических подхода. С одной стороны, это фундаментальное изучение исследуемых белков иммунной системы рыб — хемокинов CCL2, CCL3 и CCL4, а также маннан-связывающих рецепторов MRC1 и MRC2: изучение особенностей их первичных и пространственных структур современными методами биоинформатики и 3D-моделирования. С другой — практическое изучение их уровней экспрессии в норме и патологии в моделях различных бактериальных инфекций на тепловодном промысловом виде водоемов Китая (L. crocea) и холодноводном виде водоемов России (O. mykiss). Применение комбинированных методов исследования позволяет комплексно рассмотреть ряд особенностей иммунологии рыб и, в частности, сравнить реакции белков иммунной системы холодноводных и тепловодных видов.
В результате выполненного исследования впервые установлены взаимосвязи между структурой-функцией белков иммунной системы ключевых аквакультурных видов рыб Китая и России; созданы действующие модели бактериальных инфекций в экспериментальных условиях; установлены фактические уровни экспрессии белков иммунной системы в норме и патологии в динамике.
Материалы и методы исследования
Анализ первичных последовательностей исследуемых белков был произведен с помощью программ SMART; 3D-модели белков построили, используя онлайн-сервер SWISS-MODEL и Pymol.
Эксперименты проводили на рыбах Larimichthys crocea (Китай) и Oncorhynchus mykiss (Россия). Для заражения рыб модельными заболеваниями вибриоза и аэроманоза использовали бактериальные культуры Vibrio anguillarum (для L. crocea) и Aeromonas salmonicida (для O. mykiss) соответственно. Фиксирование тканей производили в растворе для консервирования образцов РНК (CW0592B, Kangwei Century, Китай). РНК из тканей и органов выделяли с помощью реагента TRIzol RNA Isolation Reagents (артикул: 9108-1, Takara, Япония); кДНК синтезировали с использованием набора для синтеза кДНК (cDNA Synthesis Kit) (H6110A, Takara, Япония); дизайн праймеров для ПЦР и ПЦР в реальном времени осуществляли с использованием программного обеспечения Primer 5.0 (http://primer3.ut.ee/); ПЦР в режиме реального времени (qRT-PCR) проводили с использованием набора премиксов SYBR ExTaq (Takara, Япония). Статистическую обработку осуществляли в программе амплификатора 7500 Real-Time PCR System (Prism® 7500, Американские прикладные биосистемы).
Анализ первичных и пространственных структур целевых белков исследуемых рыб
Организация первичной и пространственной структур хемокинов CCL2, CCL3, CCL4 L. сrocea
Кодирующая последовательность (кДНК) CCL2 (GenBank ID: MN125657) состоит из 294 пар оснований (п. о.) и 97 аминокислотных остатков (а. о.) (рис. 1 А). Молекулярный вес: 10,7 кДа, теоретическое значение изоэлектрической точки (pI): 9,55. Теоретическая модель первичной последовательности показывает, что белок CCL2 имеет два домена: первый — область низкой сложности (2–21 а. о.), второй представляет собой домен SCY (25–84 а. о.) (рис. 1 Б). Согласно построенной теоретической трехмерной модели, структура включает в себя три антипараллельных β-листа и одну α-спираль на C-конце (рис. 1 В). В SCY-домене есть четыре остатка цистеинов, среди которых два последовательных (СС), идущих друг за другом в первичной последовательности (рис. 1 А, В). Эти четыре остатка цистеина образуют две внутренние дисульфидные связи и необходимы для поддержания биологической активности.
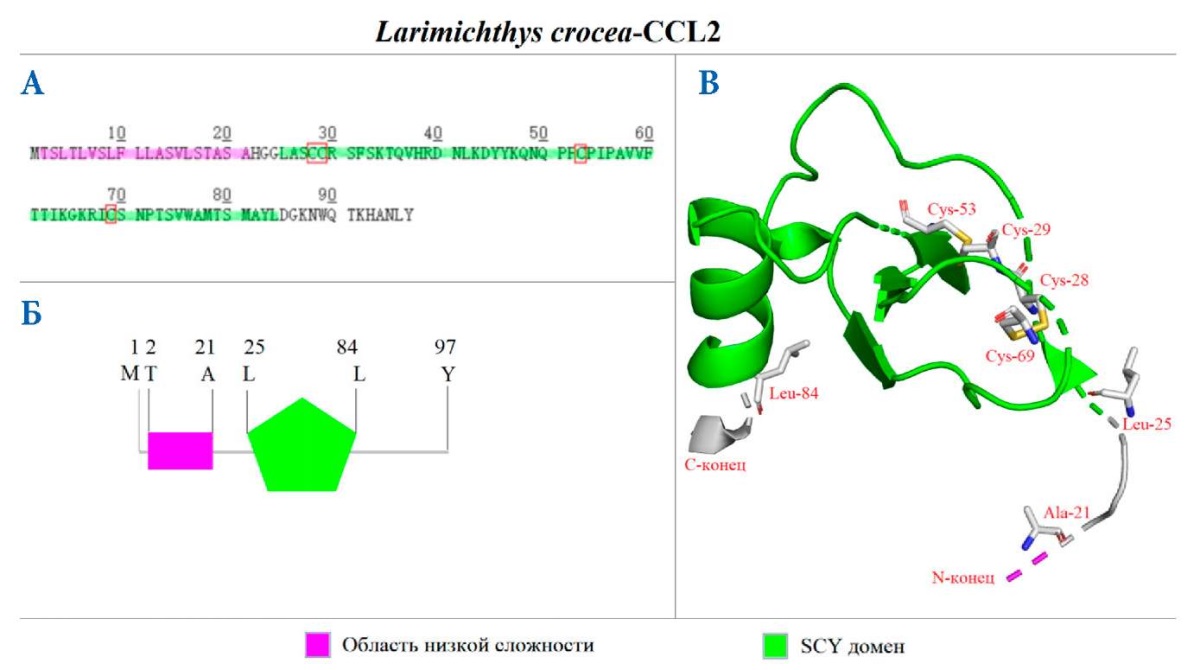
Рис. 1. Теоретические модели первичной и пространственной структур CCL2 L. crocea. Аминокислотная последовательность CCL2 L. crocea (А) и схема расположения доменов в структуре CCL2 (Б); С — трехмерная теоретическая модель CCL2 с обозначенными критически важными аминокислотами. Цветом обозначены структурные домены CCL2
Fig. 1. Theoretical models of the primary and spatial L. crocea CCL2 structures. Amino acid sequence of L. crocea CCL2 (A) and a scheme of domain location in the CCL2 structure (Б); C — 3D theoretical model of CCL2 with the labeled essential amino acids. The structural domains of CCL2 are indicated by a color.
Второй охарактеризованный нами хемокин — CCL3. Его кДНК (GenBank ID: MN125658) состоит из 309 п. о. и 102 а. о. Как и в CCL2, в CCL3 тоже есть четыре остатка цистеина, из которых два являются смежными в первичной структуре (рис. 2 А). Его предсказанный молекулярный вес — 11,3 кДа, теоретическое значение pI: 9,08. В отличие от предыдущего хемокина, CCL3 имеет в своей структуре три домена: первый представляет собой область низкой сложности (1–7 а. о.), второй — трансмембранный домен (9–31 а. о.), третий — домен SCY (32–90 а. о.) (рис. 2 Б). Все четыре остатка цистеина находятся в домене SCY, которые также образуют внутримолекулярные дисульфидные связи, необходимые для нормального функционирования хемокина (рис. 2 А, В). CCL3 тоже имеет три антипараллельных β-листа и 1 α-спираль на C-конце (рис. 2 В).
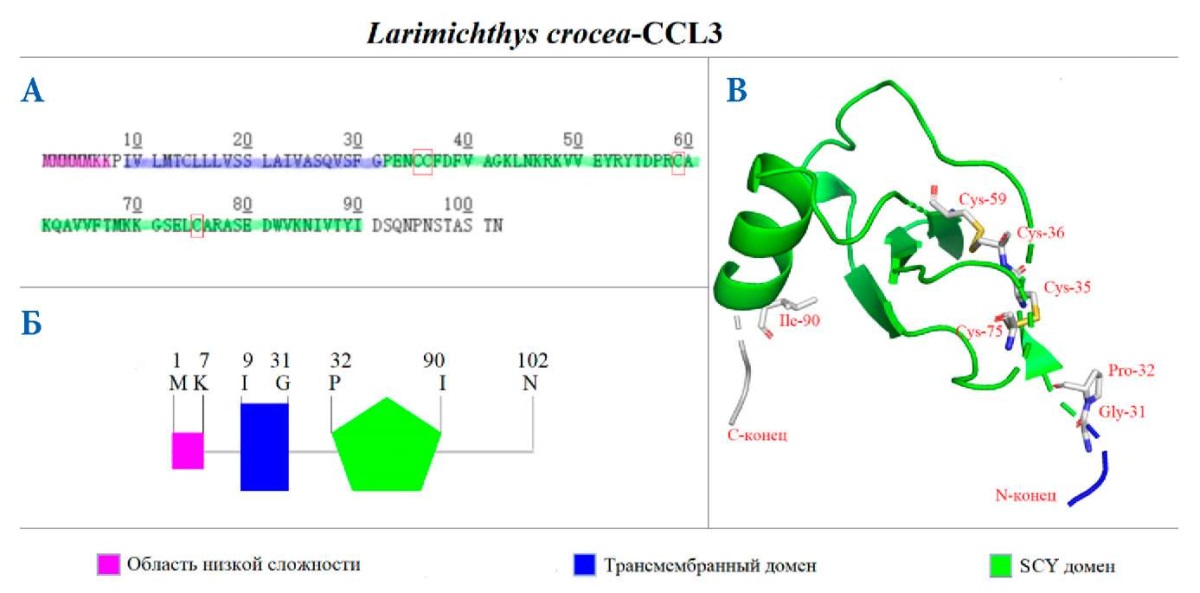
Рис. 2. Теоретические модели первичной и пространственной структур CCL3 L. crocea. Аминокислотная последовательность CCL3 L. crocea (А) и схема расположения доменов в структуре CCL3 (Б); С — трехмерная теоретическая модель CCL3 с обозначенными критически важными аминокислотами. Цветом обозначены структурные домены CCL3
Fig. 2. Theoretical models of the primary and spatial L. crocea CCL3 structures. Amino acid sequence of L. crocea CCL3 (A) and a scheme of domain location in the CCL3 structure (Б); C — 3D theoretical model of CCL3 with the labeled essential amino acids. Structural domains of CCL3 are indicated by a color.
CCL4 кДНК (GenBank ID: MN125659) которого состоит из 274 п. о., кодирующих 91 а. о. Его расчетный молекулярный вес — 10,3 кДа, значение pI: 9,17. В CCL4 тоже есть четыре остатка со схожими местоположениями (рис. 3 А). Как и CCL2, CCL4 имеет два домена: первый представляет собой трансмембранный домен (5–27 а. о.), второй — SCY домен (28–86 а. о.), в котором располагаются критически важные четыре остатка цистеина (рис. 3 Б, В).
Как и в предыдущих двух хемокинах, в CCL4 тоже имеется три антипараллельных β-листа и одна α-спираль на C-конце (рис. 3 В).
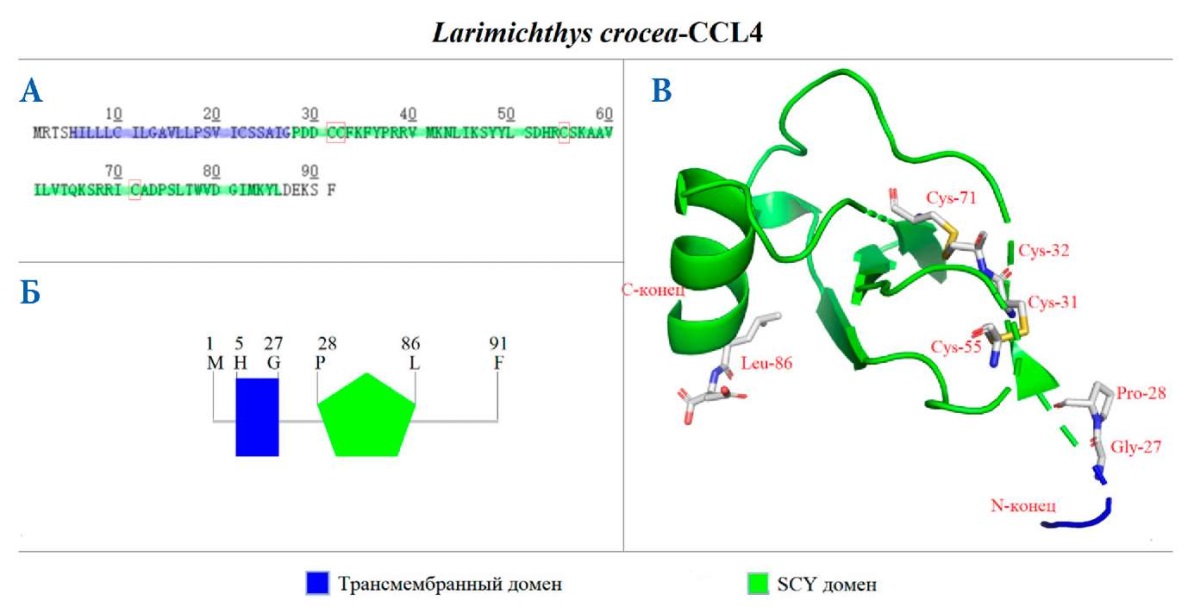
Рис. 3. Теоретические модели первичной и пространственной структур CCL4 L. crocea. Аминокислотная последовательность CCL4 L. crocea (А) и схема расположения доменов в структуре CCL4 (Б); С — трехмерная теоретическая модель CCL4 с обозначенными критически важными аминокислотами. Цветом обозначены структурные домены CCL4
Fig. 3. Theoretical models of the primary and spatial L. crocea CCL4 structures. Amino acid sequence of L. crocea CCL4 (A) and a scheme of domain location in the CCL4 structure (Б); C — 3D theoretical model of CCL4 with the labeled essential amino acids. The structural domains of CCL4 are indicated by a color.
В результате анализа первичных последовательностей и пространственных структур исследованных хемокинов L. crocea мы показали, что они имеют общий главный функциональный домен SCY, который содержит 4 остатка цистеина. Доменная структура остальных хемокинов имеет некоторые различия. Так, в отличие от CCL2, CCL3 и CCL4 имеют в своей структуре трансмембранный домен. Однако CCL2 обладает областью низкой сложности (Low complicity region), обычно эта область не несет значимых доменов.
Путем анализа первичной и третичной структур их аминокислотных последовательностей было обнаружено, что они имеют аналогичные высокоуровневые структуры, обе из которых закреплены дисульфидной цепью, образованной цистеином на свободном N-конце на трех антипараллельных β-листах, а на С-конце есть спираль, почти перпендикулярная α-листу.
N-конец CC-хемокина может активировать рецептор и оказывать хемотаксический эффект на моноциты, Т-клетки и т. д. Если N-конец удален, хемокин утратит свою способность связываться с рецептором. α-спираль на С-конце также чрезвычайно важна, когда хемокины связываются с рецепторами, поскольку α-спираль может прочно связываться с мукополисахаридом на поверхности тканей или клеток и способствовать передаче сигнала.
Особенности строения маннозных рецепторов MRC1, MRC2 L. crocea и O. mykiss
Кодирующая последовательность MRC1 (кДНК) L. crocea (GenBank ID: AKH05366). Она кодирует 19 596 п. о., что соответствует 1492 а. о. Его предсказанный молекулярный вес — 63,5 кДа, теоретическое значение pI: 5,02. Структура белка MRC1 L. crocea от N-конца до С-конца соответственно содержит домен RICIN (богатый цистеином домен, CR) (97–203 а. о.), 8 доменов CTLD (С-лектин-подобные домены) (CTLD1 — 269–397 а. о., CTLD2 — 413–536 а. о., CTLD3 — 554–676 а. о., CTLD4 — 696–822 а. о., CTLD5 — 843–964 а. о., CTLD6 — 985–1118 а. о., CTLD7 — 1133–1251 а. о. и CTLD8 — 1268~1397 а. о.), а также трансмембранный домен (1424–1446 а. о. ) (рис. 4 А). В последовательности белка MRC1 есть остаток триптофана в богатом цистеином домене (рис. 5 А). В домене CTLD обнаружены четыре двойных гидрофобных лейцина (LL) (рис. 5 А) и остаток аспарагиновой кислоты (рис. 5 А). Также в каждом домене CTLD есть 4 цистеина. Также в CTLD4 был обнаружен критический домен распознавания углеводов (CRD) EPN (Glu-Pro-Asn) (рис. 5 А).
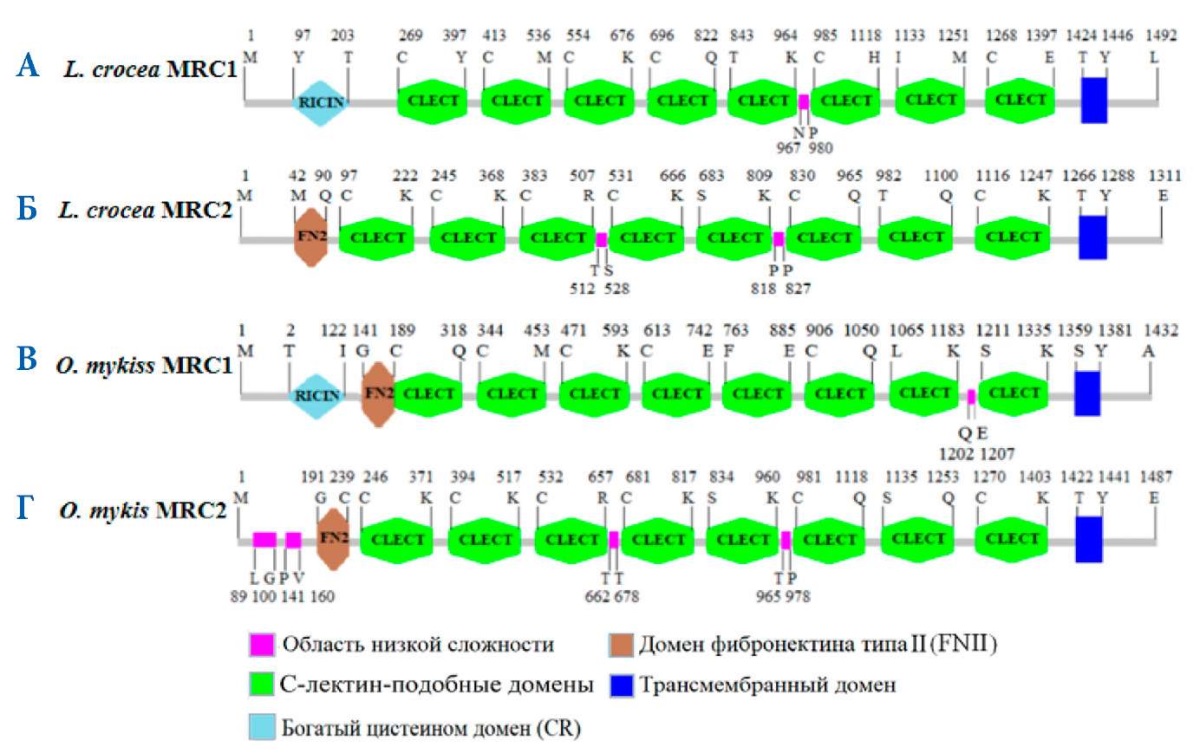
Рис. 4. Схема расположения доменов в структуре MRC1 (А, В) и MRC2 (Б, Г) L. crocea и O. mykiss. Цветом обозначены структурные домены MRC1 L. crocea и O. mykiss
Fig. 4. Domain location in the MRC1 (A, В) and MRC2 (Б, Г) structure of L. crocea and O. mykiss. The color indicates structural domains of MRC1 of L. crocea and O. mykiss
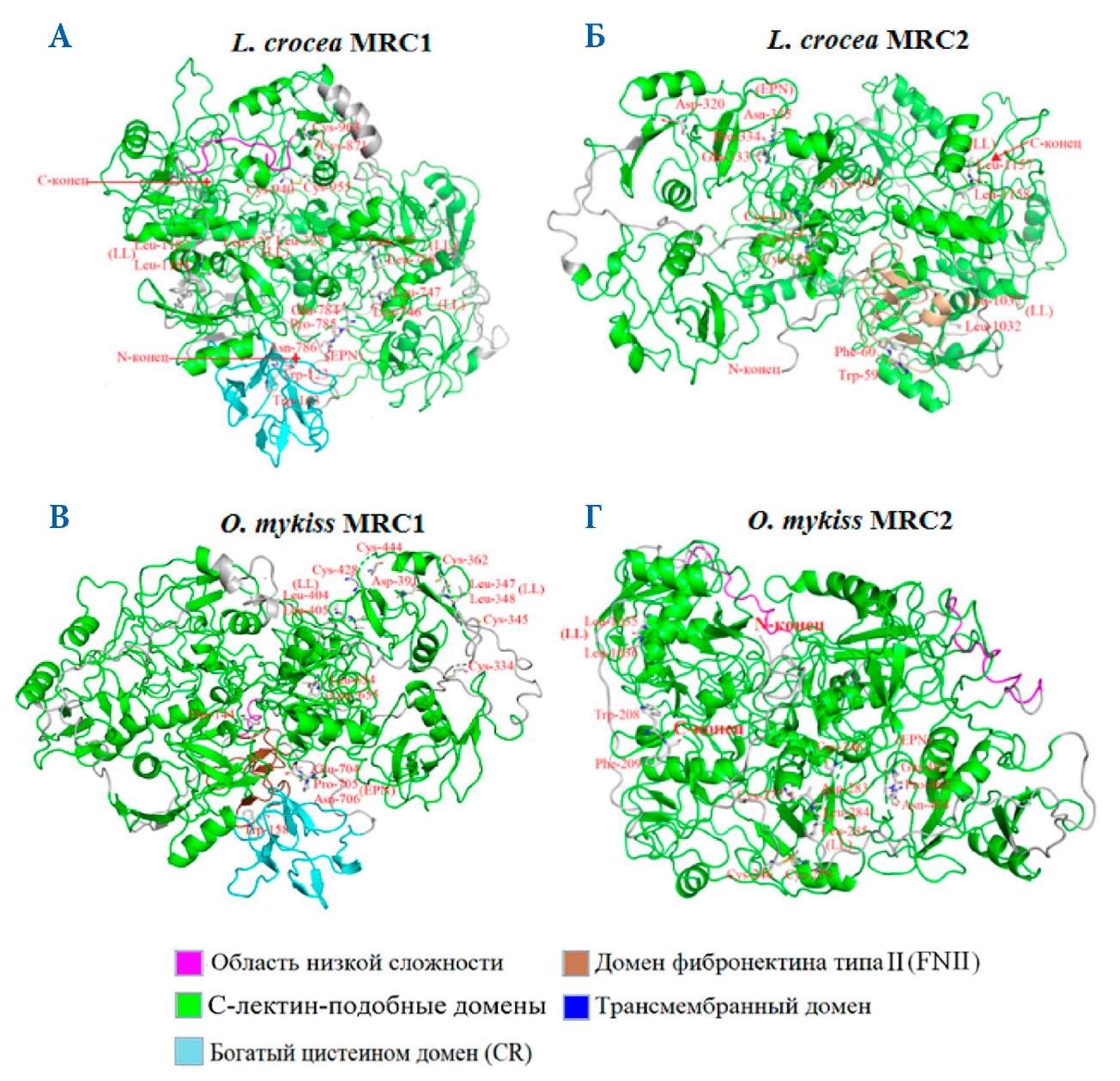
Рис. 5. Трехмерная теоретическая модель MRC1 (А, В) и MRC2 (Б, Г) L. crocea и O. mykiss с обозначенными критически важными аминокислотами. Цветом обозначены структурные домены MRC1 L. crocea и O. mykiss
Fig. 5. 3D theoretical model of MRC1 (А, В) and MRC2 (Б, Г) of L. crocea and O. mykiss with the labeled essential amino acids. The structural domains of MRC1 of L. crocea and O. mykiss are indicated by a color.
Второй охарактеризованный нами рецептор маннозы — MRC2 L. crocea. Его кДНК (GenBank ID: AKH05367) состоит из 1331 а. о. и 17 679 п. о. Его предсказанный молекулярный вес — 168,09 кДа, теоретическое значение pI: 5,83. Основные функциональные домены его белковой структуры отличаются от таковых у L. crocea MRC1. Его белковая структура содержит домен FNII (домен фибронектина типа II) (42–90 а. о., 8 доменов CTLD (CTLD1 — 97–222 а. о., CTLD2 — 245~368 а. о., CTLD3 — 383–507 а. о., CTLD4 — 531–666 а. о., CTLD5 — 683~809 а. о., CTLD6 — 830–965 а. о., CTLD7 — 982–1110 а. о., CTLD8 — 116–1247 а. о.) и трансмембранный домен (1266–1288 а. о.) (рис. 4 Б). В последовательности MRC2 связующий участок коллагена — домен FNII содержит ароматические 4 остатка фенилаланина и 3 остатка триптофана (рис. 5 Б). Область CTLD аминокислотной последовательности MRC2 имеет два CRD домена для узнавания углеводов (рис. 5 Б). Кроме того, в аминокислотной последовательности MRC2 были обнаружены два двойных гидрофобных лейцинов (LL) и большое количество а. о. аспарагиновой кислоты (D) (рис. 5 Б). Также в домене CTLD есть 4 цистеина.
Кодирующая последовательность (кДНК) MRC1 O. mykiss (GenBank ID: 110508267) состоит из 4408 п. о. и 1432 а. о. Через онлайн-сервер ExPASy ProtParam tool (https://web.expasy.org/protparam/) спрогнозированы следующие параметры: молекулярный вес (162,4 кДа) и теоретическое значение pI (5,61). Анализ первичной последовательности показывает, что белок MRC1 имеет один RICIN (домен богатый цистеином) (2–122 а. о.), один домен FNII (домен фибронектина типа II) (141–189 а. о.), 8 лектиновых доменов С-типа (CTLD1 — 189–318 а. о., CTLD2 — 344–453 а. о., CTLD3 — 471–593 а. о., CTLD4 — 613–742 а. о., CTLD5 — 763–885 а. о., CTLD6 — 906–1050 а. о., CTLD7 — 1065–11183 а. о., CTLD8 — 1211–1335 а. о.) (рис. 4 В). В последовательности MRC2 связующий участок коллагена — домен FNII содержит ароматические 3 остатка фенилаланина и 3 остатка триптофана (рис. 5 В). Область CTLD4 аминокислотной последовательности MRC2 имеет один CRD домена для узнавания углеводов (рис. 5 В). Кроме того, в аминокислотной последовательности MRC2 были обнаружены три полностью консервативных двойных гидрофобных лейцина (LL) и большое количество консервативных а. о. аспарагиновой кислоты (D) (рис. 5 В). Также в каждом домене CTLD есть 4 или 5 полностью консервативных цистеина (рис. 5 В).
Второй охарактеризованный нами рецептор маннозы — MRC2 O. mykiss. Его кДНК (GenBank ID: XP_021480466.1) состоит из 5568 п. о. и соответствующих им 1487 а. о. В последовательности O. mykiss есть три основных консервативных функциональных домена: фибронектина типа II (191–239 а. о.), 8 С-лектин-подобных доменов (CTLD1 — 246–371 а. о., CTLD2 — 394–517 а. о., CTLD3 — 532–647 а. о., CTLD4 — 681–817 а. о., CTLD5 — 834–960 а. о., CTLD6 — 981–1118 а. о., CTLD7 — 1135–1253 а. о., CTLD8 — 1270–1403 а. о.) (рис. 4 Г) и один трансмембранный домен (1422–1441 а. о.). Предсказанный молекулярный вес белка — 168,1 кДа, а теоретическое значение pI — 5,83. В аминокислотной последовательности MRC2 O. mykiss в сайте связывания коллагена имеются остатки ароматических аминокислот: 4 фенилаланина и 3 триптофана. С-лектиновая область (CTLD), MRC2 содержит домен распознавания углеводов (CRD) (EPN — Glu-Pro-Asn) (рис. 5 Г). Кроме того, в аминокислотной последовательности MRC2 были обнаружены двойной гидрофобный лейцин (LL) и кислый аминокислотный остаток аспарагиновой кислоты, также как и в предыдущем охарактеризованном нами MRC1 (рис. 5 Г).
В данном исследовании мы провели анализ последовательностей и структур кДНК MRC1 и MRC2 у L. crocea и O. mykiss. Аминокислотные последовательности MRC1 и MRC2, как и рецепторы маннозы других видов, имеют высококонсервативные структурные области, типичные характеристики семейства рецепторов маннозы, что указывает на то, что MRC1 и MRC2 являются членами суперсемейства лектинов С-типа. Лектины С-типа — это один из классов лектинов со специфическим углевод-связывающим белковым доменом. Особенностью лектинов этого класса является необходимость присутствия кальция для их связывания с лигандом. Белки, содержащие лектиновые домены C-типа, выполняют широкий спектр функций, включая клеточную адгезию, иммунный ответ на патогены и апоптоз.
У всех исследованных последовательностей MRC есть общий важный структурных домен — CTLD. В этом домене у белка MRC1 имеется богатый цистеином регион (CR) в отличие от остальных трех исследованных белков. Домен CR ассоциирован с процессом связывания углеводов благодаря способности активного центра к их распознаванию. Также в MRC2 L. crocea и O. mykiss есть FNII домен. Такой домен является наиболее консервативным доменом в семействе MRС и обладает свойством связываться с коллагеном. MRC1 и MRC2 имеют некоторые структурные различия. Это можно увидеть из схемы структуры белка. Например, у MRC1 отсутствует N-концевой участок, богатый цистеином, а имеется только участок фибронектина FNII и 8 лектин-подобных участков CTLD и цитоплазматических доменов. Стоит отметить, что оба маннозных рецепторов имеют схожие домены, но играют в клетках разные роли. MRC1 в основном участвует в врожденном иммунном ответе, а MRC2 также участвует в иммунном ответе, но согласно данным и предположениям этого исследования, его главная функция может заключаться в основном в опосредованной деградации лизосомного коллагена.
В последовательностях MRC1 и MRC2 O. mykiss и L. crocea есть похожие функциональные остатки аминокислот. Так, есть консервативный кислотный аминокислотный остаток аспарагиновой кислоты. При интернализации лиганда и миграции ранних эндосом в клетке играет роль именно этот остаток, без которого этот функциональный сайт молекулы инертен. Кроме того, у O. mykiss и L. crocea MRC1 и MRC2 были обнаружены спаренные гидрофобные остатки лейцина (LL) и консервативный аминокислотный остаток аспарагиновой кислоты, необходимый для интернализации лиганда, а также для миграции ранних эндосом внутри клетки для функционирования необходимы два вышеуказанных функциональных сайта. Присутствие триптофанов (рис. 5 A, Б, В, Г) в сайте связывания коллагена аминокислотной последовательности MRC1 и MRC2 L. crocea и MRC2 O. mykiss позволяет белкам обладать способностью к связыванию коллагена. В последовательности MRC2 обеих рыб в сайте связывания коллагена содержится фенилаланин, отсутствующий в обеих последовательностях MRC1. Область CTLD аминокислотных последовательностей MRC1 и MRC2 имеет консервативный домен распознавания углеводов (CRD) (EPN Glu-Pro-Asn), который специфически связывается с маннозой, что указывает на то, что он может обладать активностью связывания углеводов. Приведенные выше результаты показывают, что сходство последовательностей MRC2 O. mykiss и L. crocea является относительно высоким, а функциональные аминокислотные остатки относительно схожи, поэтому можно сделать вывод, что биологические функции двух белков относительно схожи. Однако эти активные сайты нуждаются в дальнейших экспериментах для проверки в будущем.
Паттерны экспрессии генов иммунных белков L. crocea
Распределение уровней мРНК хемокинов CCL2, CCL3, CCL4 в норме
Экспрессия мРНК CCL2, CCL3 и CCL4 была обнаружена во всех восьми проанализированных органах: печени, почках, селезенке, мышцах, сердце, мозге, кишечнике и жабрах перед заражением Vibrio anguillarum. Экспрессия мРНК CCL2 CCL3 и CCL4 в печени, почках и селезенке была значительно выше, чем в других органах (рис. 6 А, Б, В).
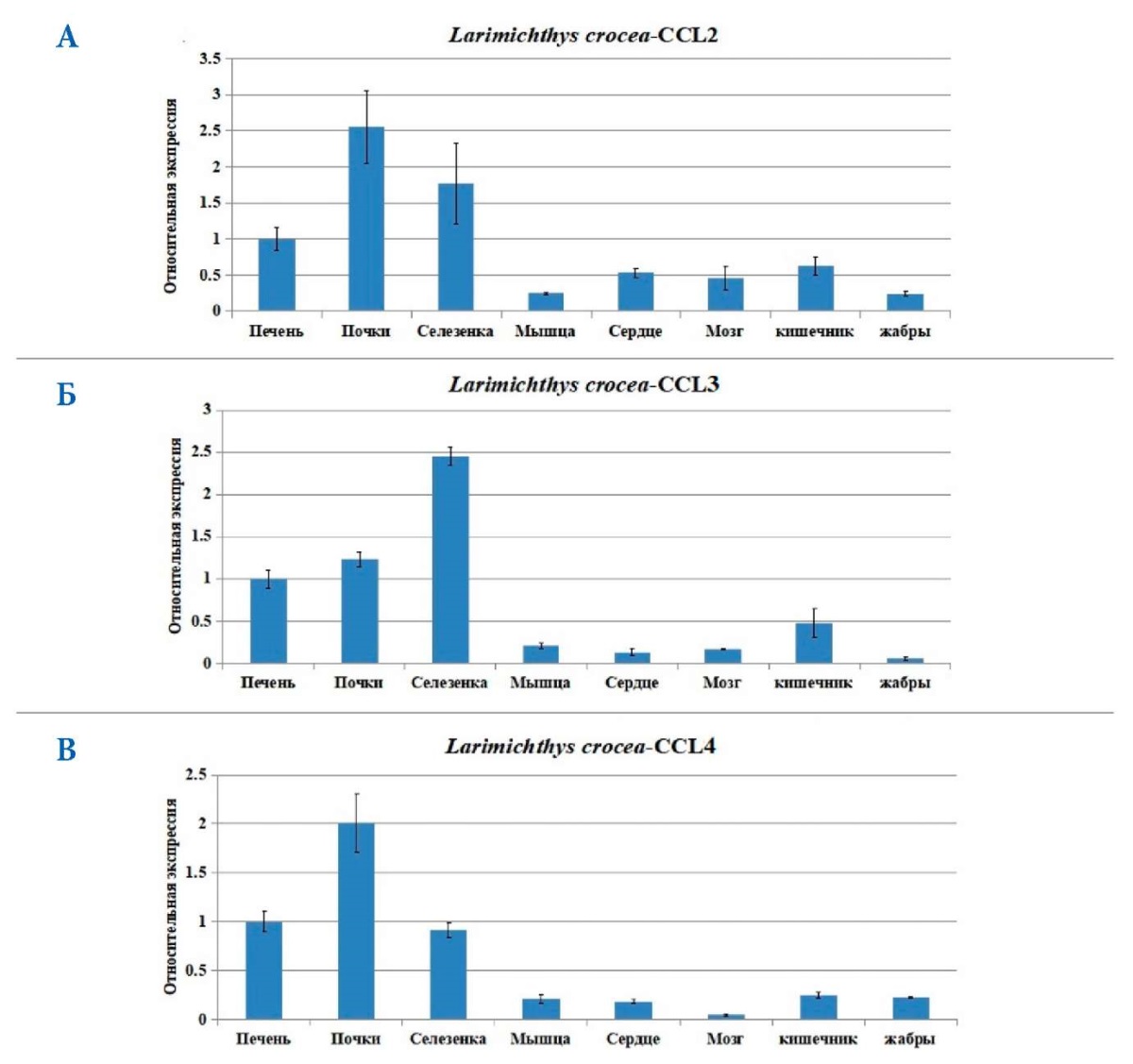
Рис. 6. Распределение уровней экспрессии мРНК CCL2 (А), CCL3 (Б) и CCL4 (В) перед заражением V. anguillarum в печени, почках, селезенке, мышцах, сердце, мозге, кишечнике и жабрах, полученное методом ПЦР в реальном времени. Стандартное отклонение (± SD) представлено по пяти техническим повторностям; n = 3 / группа / период времени
Fig. 6. Distribution of CCL2 (A), CCL3 (Б), and CCL4 (В) mRNA expression levels prior to V. anguillarum infection in the liver, kidney, spleen, muscle, heart, brain, intestine, and gills obtained by real-time PCR. Standard deviation (± SD) is presented across five technical repetitions; n = 3 / group / time period
В этом эксперименте CCL2, CCL3 и CCL4 L. crocea также были обнаружены в печени, почках, селезенке, сердце, мышцах, кишечнике, мозге и жабрах. Показано, что большинство хемокинов рыб экспрессируются в широком спектре. Результаты исследований указывают на то, что хемокины рыб не только играют важную роль в процессах, связанных с иммунитетом, но также могут участвовать в других физиологических процессах в организме.
Распределение хемокинов в разных тканях в норме различно. Однако большинство хемокинов в основном экспрессируются в тканях, связанных с иммунитетом (печень, почки и селезенка). То же самое наблюдали и для CCL2, CCL3 и CCL4 в органах у большого желтого горбыля в этом эксперименте. Поскольку в печени, почках и селезенке рыб содержится большое количество иммунных клеток, таких как макрофаги и лимфоциты, экспрессия хемокинов в печени, почках и селезенке ожидаемо высока.
Анализ уровней мРНК CCL2, CCL3 и CCL4 в модели вибриоза
Для выяснения распространения воспаления среди разных органов и тканей в динамике на примере иммунных белков хемокинов была построена модель вибриоза у промыслового вида Китая — большого желтого горбыля с помощью патогенной бактерии V. anguillarum. В качестве контроля наличия воспаления был введен препарат Poly I:C, вызывающий неспецифическое воспаление.
После заражения патогеном были проанализированы уровни экспрессии CCL2, CCL3 и CCL4 в динамике от начала эксперимента до 72 часов (рис. 7). В результате проведения ПЦР в реальном времени исследованных органов (печень, почки, селезенка) в различных временных точках было обнаружено, что острая фаза воспаления была уже спустя 6 часов после начала эксперимента: экспрессия всех трех хемокинов была существенно повышена по сравнению с контролем. Исключением оказался CCL4: накопление продуктов экспрессии его гена в селезенке достигло своего максимума только спустя 12–24 часа, что, видимо, связано с особенностями экспрессии этого хемокина при системном воспалении. Спустя 36 часов и до конца эксперимента наблюдалось общее снижение уровней мРНК хемокинов и стабилизация степени их экспрессии практически на одном уровне.
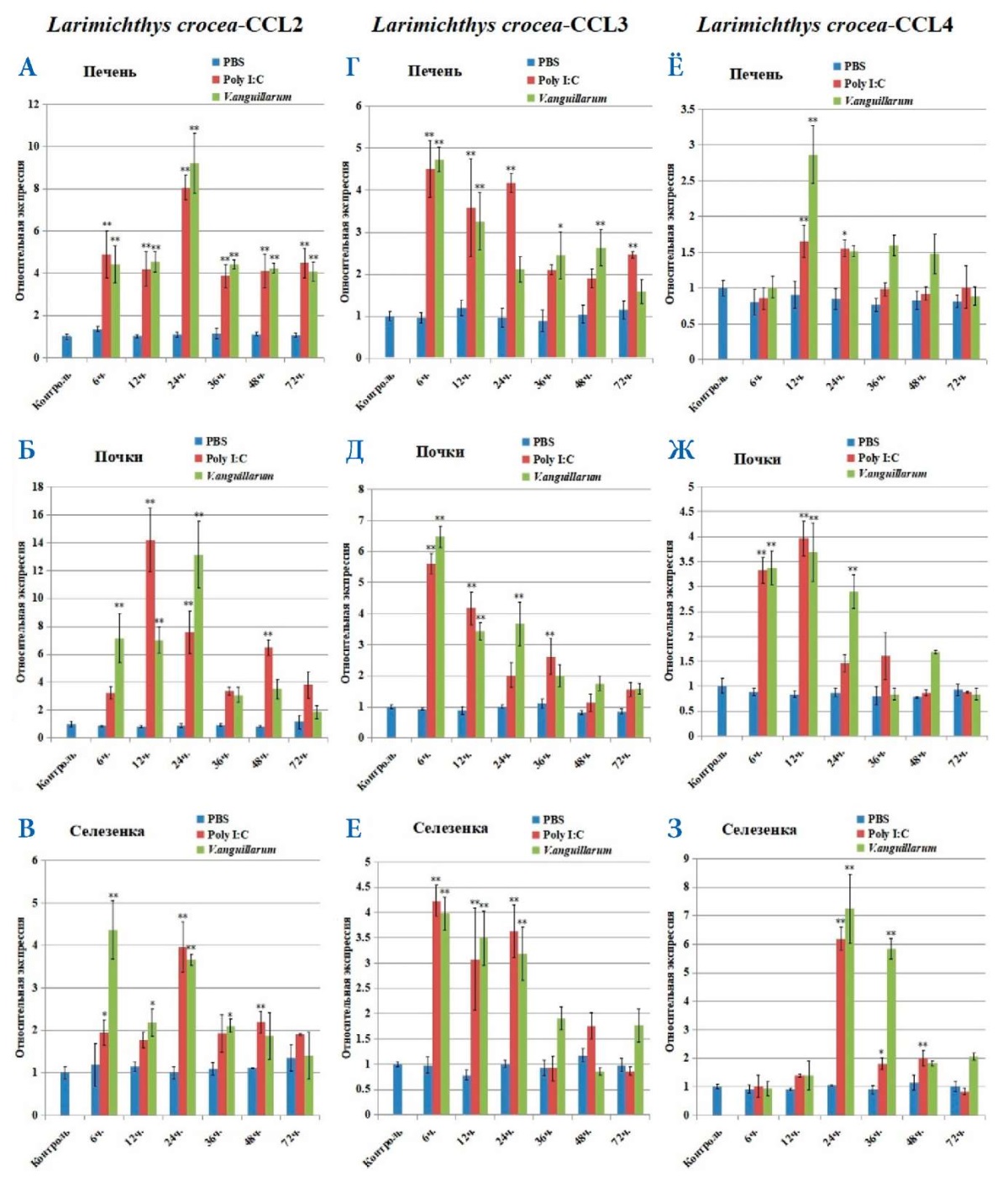
Рис. 7. Результаты ПЦР в реальном времени экспрессии в динамике хемокинов L. crocea в печени, почках и селезенке после введения PBS (отрицательный контроль), Poly I:C (положительный контроль наличия воспаления) и V. anguillarum. А, Б, В — CCL2; Г, Д, Е — CCL3; Е, Ж, З — CCL4 в тканях печени, почек и селезенки после заражения V. anguillarum, Poly I: C и PBS. Стандартное отклонение (± SD) представлено по пяти техническим повторностям; звездочки над полосами представляют собой статистически значимые отличия от контрольных образцов; * — при p < 0,05, ** — при p <0,01, n = 3 / группа / период времени
Fig. 7. Real-time PCR of dynamic expression of L. crocea chemokines in the liver, kidney, and spleen after administration of PBS (negative control), Poly I:C (positive control for the presence of inflammation), and V. anguillarum. А, Б, В — CCL2; Г, Д, Е — CCL3; Е, Ж, З — CCL4 in the liver, kidney, and spleen tissues after infection with V. anguillarum, Poly I:C, and PBS. Standard deviation (± SD) is presented across five technical repetitions; asterisks above bars represent statistically significant differences from control samples; * — at p < 0.05, ** — at p < 0.01, n = 3 / group / time period
После экспериментального заражения бактерией V. anguillarum в органах L. crocea мы обнаружили, что экспрессия мРНК генов CCL2, CCL3 и CCL4 была тесно связана с процессом заражения патогеном, что позволяет утверждать, что эти хемокины участвуют в иммунитете рыб против бактериальной инфекции, что согласуется с общемировой литературой. Показано, что иммунологические эффекты CCL у L. crocea слабее, чем у других рыб, что может быть механизмом повышенной инфекционности L. crocea.
Эти результаты показали, что xемокины CCL2, CCL3, CCL4 оказывают регулирующее действие на воспалительный ответ. Как было показано нами ранее, другая группа хемокинов CCL17, CCL21 и CCL24 экспрессируется в тех же органах иначе. Их экспрессия слабее, чем у CCL2, CCL3 и CCL4, что связано с их функциями. Они являются провоспалительными хемокинами, а их рецепторами являются CCR1, CCR2 и CCR5 соответственно.
Организм выполняет функцию презентации антигена, и он легко накапливается в очаге воспаления и поглощает антиген, который играет роль в воспалительной реакции и сопротивляется инфекции патогена в патологическом процессе. И CCL17, CCL21 и CCL24 считаются двойными хемокинами, а также гомеостатическими хемокинами. Так, изменения экспрессии CCL21 в печени, почках и селезенке после заражения V. anguillarum не были очевидны. На основании этого предполагается, что это связано с его гомеостатическим эффектом. Из приведенного выше анализа можно сделать вывод, что не все хемокины у L. crocea могут играть воспалительную роль в отношении вибриоза и не все хемокины обладают функцией подавления бактериальных инфекций, а также, вероятно, могут усугублять бактериальные инфекции.
Распределение уровней мРНК маннозных рецепторов MRC1 и MRC2 в норме
Предварительная оценка уровней экспрессии генов рецепторов маннозы была проведена для понимания общих нормальных (фоновых) уровней экспрессии рецепторов маннозы в печени, почках и селезенке большого желтого горбыля.
Экспрессия мРНК MRC1 и MRC2 была обнаружена во трех проанализированных органах: печени, почках и селезенке перед заражением V. anguillarum. Экспрессия мРНК MRC1 и MRC2 в печени, почках и селезенке была значительно выше нормы (рис. 8 A, Б).
Показано, что для разных генов максимальные значения экспрессии появляются в разных органах в зависимости от основных биологических функций генов.
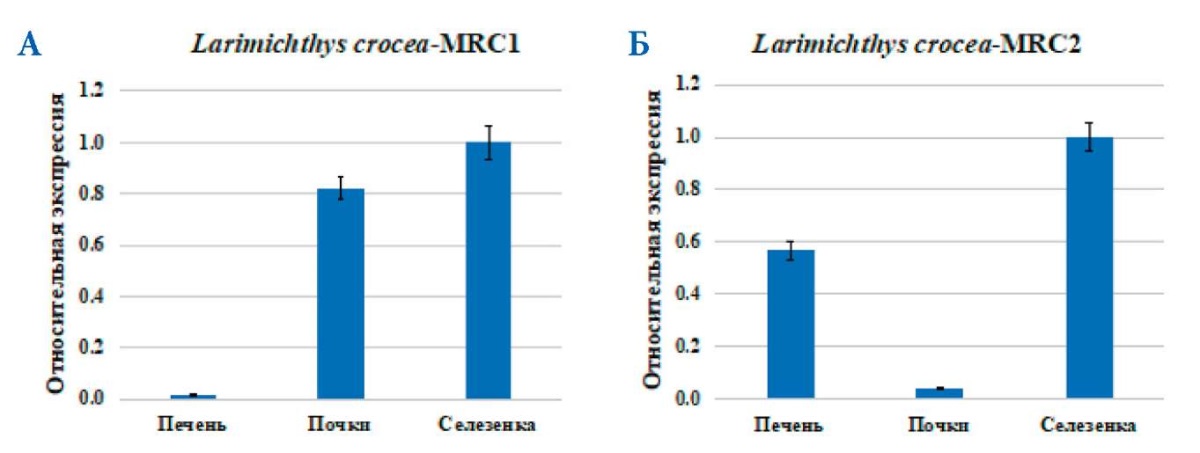
Рис. 8. Результат RT-PCR экспрессии мРНК MRC1 (А) и MRC2 (Б) перед заражением V. anguillarum в ткани печени, почек, селезенки у L. crocea. Стандартное отклонение (± SD) представлено по пяти техническим повторностям; n = 3 / группа / период времени
Fig. 8. RT-PCR result of MRC1 (A) and MRC2 (Б) mRNA expression prior to V. anguillarum infection in the liver, kidney, and spleen tissue in L. crocea. Standard deviation (± SD) is presented across five technical repetitions; n = 3 / group / time period
Анализ уровней мРНК MRC1 и MRC2 в модели вибриоза
После заражения патогеном были проанализированы уровни экспрессии MRC1 и MRC2 в динамике от начала эксперимента до 72 часов (рис. 9 A, Б, В, Г, Д, Е). В результате проведения ПЦР в реальном времени исследованных органов (печень, почки, селезенка) для мРНК MRC1 в различных временных точках было обнаружено, что острая фаза воспаления была спустя 24–36 часов после начала эксперимента: экспрессия обоих рецепторов маннозы была существенно повышена по сравнению с контролем, в 24–36 часов относительная экспрессия достигла максимальных значений (рис. 9 А, Б, В). Но уровни экспрессии мРНК MRC2 разнятся с мРНК MRC1: накопление продуктов экспрессии MRC2 происходит только спустя 24–36 часов после заражения (рис. 9 Г, Д, Е), а MRC1 экспрессировался уже спустя 6 часов во всех исследованных органах (рис. 9 А, Б, В). Очевидно, это связано с особенностями экспрессии этого рецептора при системном воспалении. В промежутке между 36 и 48 часами и до конца эксперимента наблюдалось общее снижение уровней мРНК рецепторов маннозы (рис. 9 А, Б, В, Г, Д, Е). Что касается введенного неспецифического агента Poly I:C, для мРНК MRC1 за 12 часов часов в трех органах относительная экспрессия достигла максимальных значений, а для мРНК MRC2, как после заражения V. anguillarum, за 6 часов в трех органах острая фаза воспаления была уже пройдена и экспрессия всех трех рецепторов маннозы была существенно повышена по сравнению с контролем (рис. 9 Г, Д, Е).
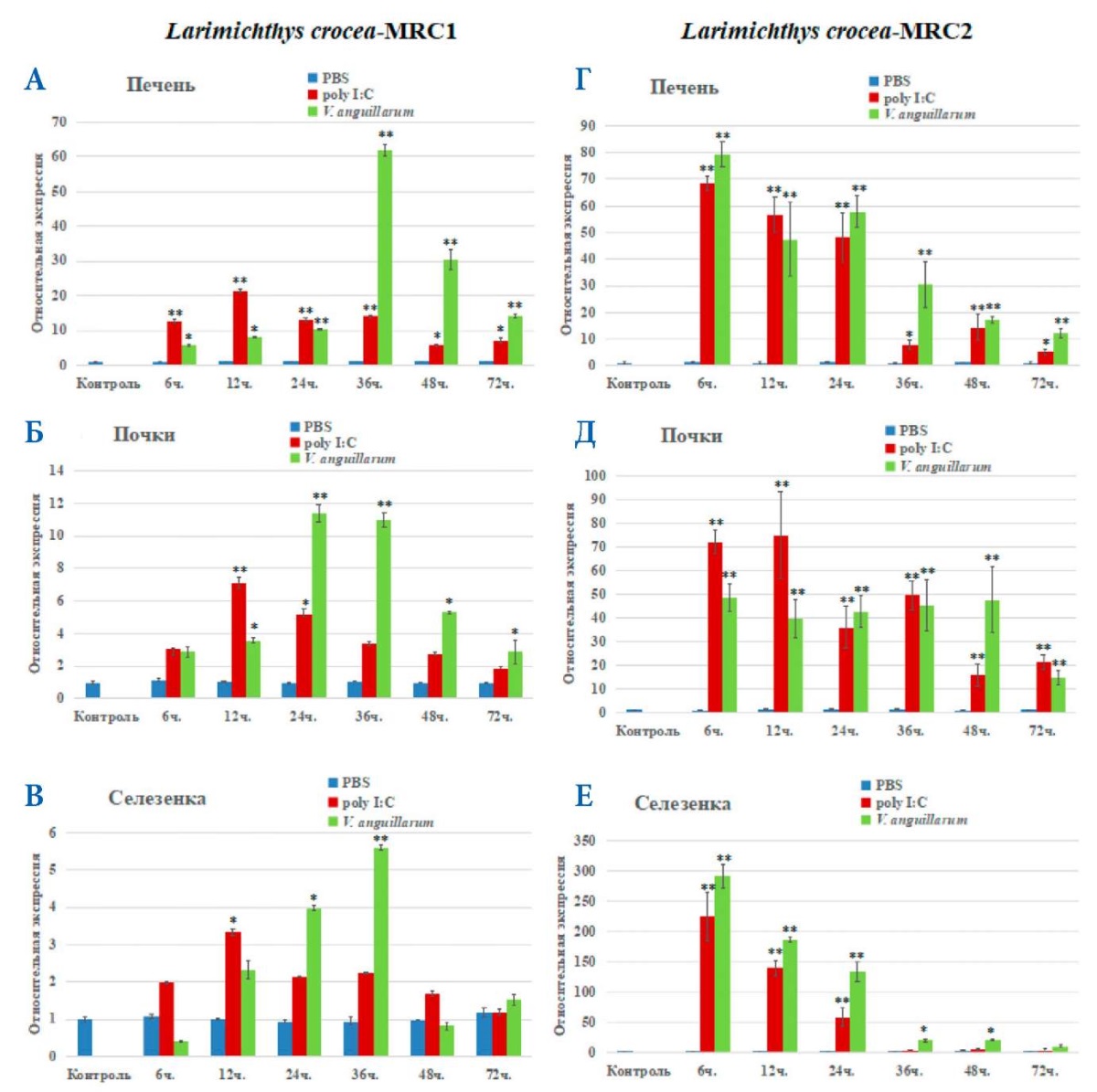
Рис. 9. Экспрессия мРНК MRC1 (А, Б, В) и MRC2 (Г, Д, Е) у L. crocea в печени, почках и селезенке после заражения V. anguillarum, Poly I: C и PBS. Стандартное отклонение (± SD) представлено по пяти техническим повторностям; звездочки над полосами представляют собой статистически значимые отличия от контрольных образцов; * — при p < 0,05, ** — при p < 0,01; n = 3 / группа / период времени
Fig. 9. MRC1 (А, Б, В) and MRC2 (Г, Д, Е) mRNA expression in L. crocea liver, kidney, and spleen after infection with V. anguillarum, Poly I: C and PBS. Standard deviation (± SD) is presented across five technical repetitions; asterisks above bars represent statistically significant differences from control samples; * — at p < 0.05, ** — at p < 0.01; n = 3 / group / time period
В этом исследовании после искусственного заражения бактерией V. anguillarum в органах L. crocea мы обнаружили, что экспрессия мРНК генов MRC1 и MRC2 была тесно связана с процессом заражения патогеном, что позволяет утверждать, что эти рецепторы маннозы участвуют в иммунитете рыб против бактериальной инфекции, что согласуется с общемировой литературой.
Таким образом, можно сделать вывод, что мРНК MRC1 и MRC2 L. crocea в основном экспрессируются в печени, почках и селезенке, а уровни их экспрессии в этих органах различаются, а уровни экспрессии MRC1 и MRC2 в одном и том же органе также значительно различаются.
На основе полученных данных, уровни экспрессии в печени, почках и селезенке в органах L. crocea после заражения V. anguillarum были значительно увеличены, что указывает на то, что гены рецепторов маннозы MRC1 и MRC2 оказывают регулирующее влияние на вибриоз желтого горбыля. Этот результат может иметь значение для изучения генов MRC и их экспрессии в большом желтом горбыле, для понимания механизма противоинфекционного иммунного ответа рыб и для контроля болезни большого желтого горбыля.
Анализ экспрессии мРНК MRC1 и MRC2 в печени, почках и селезенке у L. crocea после заражения V. anguillarum показал, что кривая экспрессии MRC1 отличается от кривой экспрессии MRC2. Для мРНК MRC1 относительная экспрессия в печени, почках и селезенке сначала медленно увеличивалась в течение 24 и 48 часов, изменение относительной экспрессии достигло максимального значения, а затем экспрессия медленно снижалась. Но для мРНК MRC2 относительное изменение экспрессии в печени, почках и селезенке в течение 6 часов уже сразу достигло максимального значения, а затем постепенно снижалось до конечной точки эксперимента. Это также указывает на то, что основные функции MRC1 и MRC2 могут быть разными, на что также указывают литературные данные.
Паттерны экспрессии генов иммунных белков O. mykiss
Распределение уровней мРНК маннозных рецепторов MRC1 и MRC2 в норме
Предварительная оценка уровней экспрессии генов рецепторов маннозы была проведена для понимания общих нормальных (фоновых) уровней экспрессии рецепторов маннозы в печени, почках и селезенке радужной форели. Экспрессия мРНК MRC1 и MRC2 была обнаружена во всех трех проанализированных органах: печени, почках и селезенке перед заражением Aeromonas salmonicida ssp. Экспрессия мРНК MRC1 была самой высокой в селезенке, а экспрессия мРНК MRC2 — в печени (рис. 10 A, Б).
мРНК MRC рыб широко экспрессируется во многих органах, особенно в почках и селезенке, и играет важную роль в бактериальном иммунном ответе [1–9].
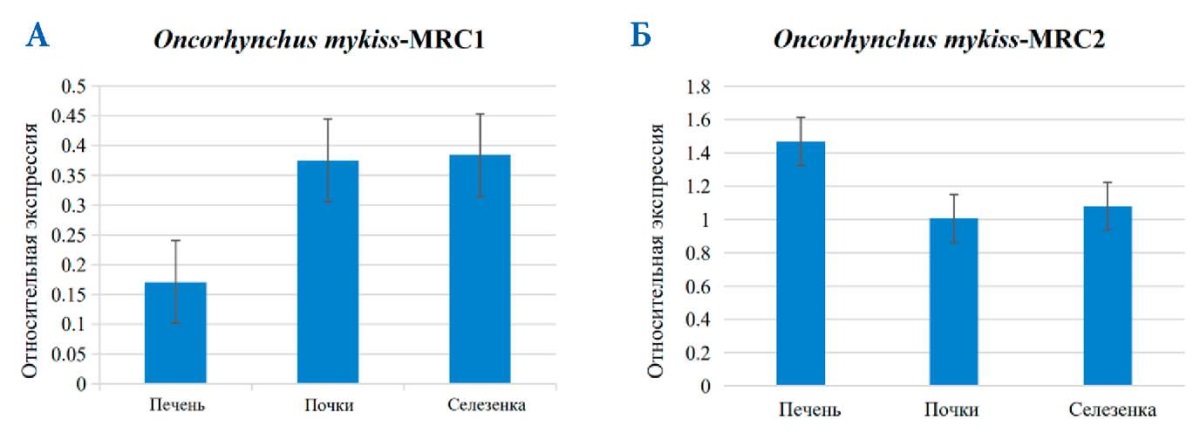
Рис. 10. Экспрессия мРНК MRC1 (А) и MRC2 (Б) в печени, почках и селезенке здоровых образцов у O. mykiss. Стандартное отклонение (± SD) представлено по пяти техническим повторностям; n = 3 / группа / период времени
Fig. 10. MRC1 (A) and MRC2 (Б) mRNA expression in the liver, kidney, and spleen of healthy O. mykiss specimens. Standard deviation (± SD) is presented across five technical repetitions; n = 3 / group / time period
Анализ уровней мРНК MRC1 и MRC2 в модели аэромоноза
Во время вскрытия рыб в конечных точках эксперимента была проведена морфологическая оценка их состояния в сравнении с контролем. После заражения A. salmonicida ssp. изменение поверхности тела O. mykiss было неочевидно, но объем печени у зараженных рыб был больше, чем у здоровой рыбы.
После заражения патогеном были проанализированы уровни экспрессии MRC1 и MRC2 O. mykiss в динамике от начала эксперимента до 72 часов (рис. 11 А, Б, В, Г, Д, Е). Проведена ПЦР в реальном времени исследованных органов (печень, почки, селезенка) для мРНК MRC1 O. mykiss в различных временных точках. Для MRC1 в почках и селезенке (рис. 11 Б, В) и для MRC2 в печени и селезенке было обнаружено (рис. 11 Г, Е), что острая фаза воспаления наступала спустя 24–36 часов после начала эксперимента: экспрессия рецепторов маннозы была существенно повышена по сравнению с контролем, в 24–36 часов относительная экспрессия достигла максимальных значений (рис. 11 Б, В, Г, Е).
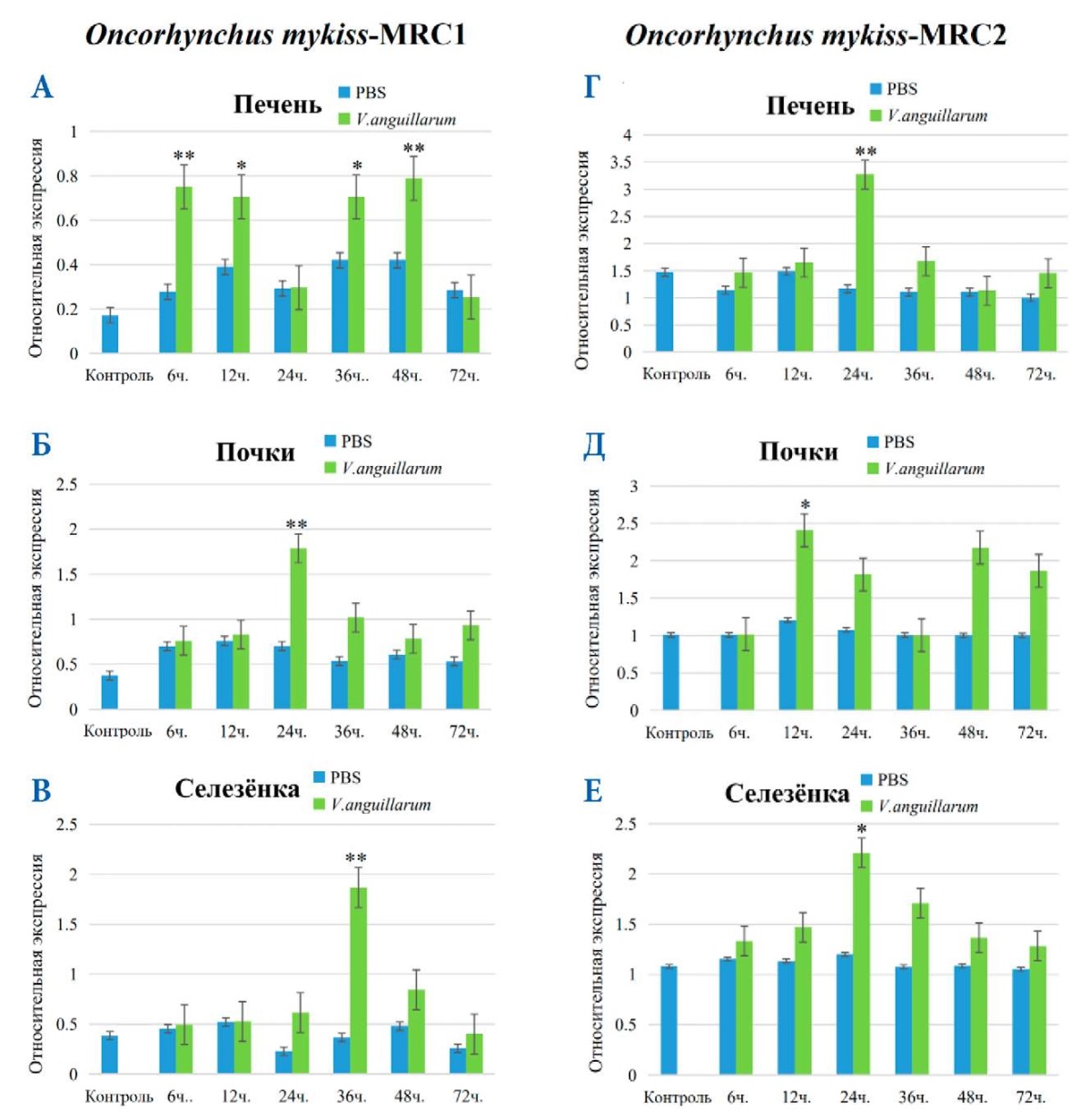
Рис. 11. Экспрессия мРНК MRC1 (А, Б, В) и MRC2 (Г, Д, Е) у O. mykiss в печени, почках и селезенке после заражения A. salmonicida ssp. и PBS. Стандартное отклонение (± SD) представлено по пяти техническим повторностям; звездочки над столбцами представляют статистически значимые отличия от контрольных образцов; * — при p < 0,05, ** — при p < 0,01; n = 3 / группа / период времени
Fig. 11. MRC1 (А, Б, В) and MRC2 (Г, Д, Е) mRNA expression in the O. mykiss liver, kidney, and spleen after infection with A. salmonicida ssp. and PBS. Standard deviation (± SD) is presented across five technical repetitions; asterisks above bars represent statistically significant differences from control samples; * — at p < 0.05, ** — at p < 0.01; n = 3 / group / time period
Спустя 24 часа от начала заражения наблюдалось временное повышение экспрессии MRC1 в почках (рис. 11 Б), в то время как в печени его экспрессия снизилась (рис. 11 A). После этой переломной точки в экспрессии наблюдалась вторая волна экспрессии MRC1 в печени в точках 36 и 48 ч (рис. 11 A). Этот феномен требует дополнительных экспериментов и подтверждений перед достоверными выводами и предположениями.
В результате изучения уровней экспрессии маннозных рецепторов у форели и большого желтого горбыля можно заключить, что уровни их экспрессии не были равны до и после заражения. Это исследование показывает, что накопление мРНК при заражении осуществляется в одних и тех же органах. Важно, что относительные уровни экспрессии генов в печени после заражения V. anguillarum у L. crocea в 60 (MRC1) (рис. 9 A) и 70 раз (MRC2) (рис. 9 Г) выше, чем у контрольной группы, и даже относительные уровни экспрессии мРНК MRC2 в селезенке после заражения V. anguillarum в 250 раз больше (рис. 9 В), чем в контрольной группе. С другой стороны, в печени O. mykiss после заражения A. salmonicida ssp. относительная экспрессия мРНК MRC1(рис. 11 A) и MRC2 (рис. 11 Г) была всего в 4 и 2 раза выше, чем у контрольной группы. Это показывает, что, хотя мРНК MRC1 и MRC2 широко экспрессируется в тканях L. crocea и O. mykiss, ее специфическая экспрессия отличается, что связано с температурой, размером рыбы и типом инфицированных бактерий, иммунным статусом рыб.
Проанализированный иммунный ответ генов хемокинов L. crocea и маннозных рецепторов O. mykiss в моделях вибриоза и аэромороза соответственно дополнит имеющиеся знания о развитии заболеваний промысловых видов рыб в динамике и поможет осуществить дальнейшие исследования в области их иммунитета и механизмов общей иммунной регуляции.
Выводы
- Впервые построены теоретические пространственные структуры хемокинов CCL2, CCL3, CCL4, а также маннозных рецепторов MRC1 и MRC2 двух промысловых и выращиваемых в условиях аквакультуры видов рыб Китая (L. crocea) и России (O. mykiss). Установлено, что CCL3 и CCL4 являются структурно гомологичными белками, а в структуре CCL2 отсутствует трансмембранный домен. Подтвержден факт высоких идентичностей первичных последовательностей маннозных рецепторов MRC1 и MRC2 у обоих видов рыб, достигающих 84 %, а также и 3D-моделей, что подтверждает высокую консервативность этих белков вне зависимости от вида и среды их обитания.
- Созданы in vivoмодели двух типичных заболеваний аквакультурных видов рыб — вибриоз на примере L. crocea и аэромоноз на примере O. mykiss с помощью инъекций культур патогенных бактерий V. anguillarum и A. salmonicida spp. Подтверждена эффективность заражения визуальными морфологическими изменениями внутренних органов рыб.
- Установлено, что хемокины CCL2, CCL3 и CCL4 распределены в норме по всем органам рыбы, а наибольшая их экспрессия наблюдается в печени, почках и селезенке. В модели вибриоза их относительные уровни экспрессии генов в печени, почках и селезенке схожи. Гены CCL2 и CCL3 реагируют на инфекцию значительно быстрее, проявляя максимум активности спустя 6 часов, а экспрессия CCL4 достигает своего максимума лишь спустя 12 часов.
- Исследованы паттерны экспрессии маннозных рецепторов MRC1 и MRC2 в различных органах и тканях у тепловодного и холодноводного промыслово-аквакультурных видов рыб Китая и России в моделях вибриоза и аэромоноза соответственно. Установлено, что при схожих локализациях их экспрессии (печень, почки, селезенка) у тепловодного L. croceaиммунный ответ на заражение в созданных моделях наступает быстрее и проявляется интенсивнее, чем у холодноводного O. mykiss.
Вклад авторов
Дун Сянли — разработка концепции исследования, проведение экспериментов, подготовка иллюстративного материала;
Шилин Михаил Борисович — разработка концепции исследования, обработка материалов экспериментов;
Леонтьева Екатерина Олеговна — обработка статистического материала, подготовка статьи к публикации.
Authors’ contributions
Dong Xiangli — development of the research concept, conducting experiments, preparation of illustrative material;
Mikhail B. Shilin — development of the research concept, processing of experimental materials;
Ekaterina O. Leonteva — processing of statistical material, preparation of the article for publication.
Список литературы
1. Dong X., Li J., He J., Liu W., Jiang L., Ye Y., Wu C. Anti-infective mannose receptor immune mechanism in large yellow croaker (Larimichthys crocea). Fish & Shellfish Immunology. 2016;54:257–265. https://doi.org/10.1016/j.fsi.2016.04.006
2. Liu W., Jiang L., Dong X., Liu X., Kang L., Wu C. Molecular characterization and expression analysis of the large yellow croaker (Larimichthys crocea) complement component C6 after bacteria challenge. Aquaculture. 2016;458:107–112. https://doi.org/10.1016/j.aquaculture.2016.03.003
3. He J., Liu H., Yang J., Dong X., Wu C. Abundant members of Scavenger receptors family and their identification, characterization and expression against Vibrio alginolyticus infection in juvenile Larimichthys crocea. Fish & Shellfish Immunology. 2016;50:297–309. https://doi.org/10.1016/j.fsi.2016.02.009
4. Li J., Zu T., Dong X., Yang X. Liu W., Wu C. Characterization of Dual and Homeostatic Chemokine Expression and Response to Bacterial Infection in Large Yellow Croaker (Larimichthys crocea). Pakistan Journal of Zoology. 2018;50(4):1199–1600. https://doi.org/10.17582/journal.pjz/2018.50.4.1373.1380
5. Шилин М.Б., Жигульский В.А., Бобылев Н.Г., Ахмад Алаа, Леднова Ю.А., Дун С. Развитие комплекса компенсационных мероприятий по снижению негативного воздействия строительства аванпорта Бронка на Южном берегу Невской губы. Естественные и технические науки. 2020;(3):178–188.
6. Дун С., Шилин М.Б., Апаликова О.В., Лукина Ю.Н. Исследование молекулярных механизмов иммунитета для борьбы с инфекциями в аквакультуре. В: География: развитие науки и образования. Коллективная монография по материалам ежегод. междунар. науч.-практ. конф., Санкт-Петербург, 22–25 апр. 2020 г. Т. 2. Санкт-Петербург: Российский государственный педагогический университет им. А. И. Герцена; 2020, с. 48–52.
7. Дун С., Шилин М.Б., Лукина Ю.Н. Исследование механизмов иммунного ответа для разработки новой технологии защиты рыб от инфекций в условиях аквакультуры. В: Современные проблемы гидрометеорологии и мониторинга окружающей среды на пространстве СНГ. Сб. тезисов Междунар. науч.-практ. конф., Санкт-Петербург, 22–24 окт. 2020 г. Санкт-Петербург: Российский государственный гидрометеорологический университет; 2020, с. 497–498.
8. Дун С., Шилин М.Б. Текущее состояние аквакультуры и методы защиты аквакультуры в Китае. В: Гидрометеорология и Экология: Достижения и перспективы развития / MGO 2020 им. Л. Н. Карлина: тр. IV Всерос. конф., Санкт-Петербург, 16–17 дек. 2020 г. Санкт-Петербруг: Химиздат; 2020, с. 131–134.
9. Дун С., Шилин М.Б. Современное состояние и задачи развития аквакультуры в Китае. В: Экологическая деятельность и экологическое просвещение: региональный аспект. Материалы Всерос. науч. конф., Санкт-Петербург, 16 дек. 2020 г. Санкт-Петербург: Ленинградский государственный университет имени А.С. Пушкина; 2020, с. 255–258.
10. Дун С. Обеспечение устойчивого развития аквакультуры путем повышения естественного иммунитета культивируемых рыб. В: XXV юбилейные Царскосельские чтения. Материалы междунар. науч. конф., Санкт-Петербург, 20–21 апр. 2021 г. Т. I. Санкт-Петербург: Ленинградский государственный университет имени А.С. Пушкина; 2021, с. 77–82.
Об авторах
Сянли ДунКитай
Дун Сянли — старший преподаватель, Национальный инженерный исследовательский центр морской аквакультуры
провинция Чжэцзян, г. Чжоушань, южная дорога Хайда № 1, 316022
Web of Science ResearcherID: LFT-8047-2024
Scopus Author ID: 57118590900
ORCID: https://orcid.org/0000-0003-1217-2013
М. Б. Шилин
Россия
Шилин Михаил Борисович — доктор географических наук, профессор
195027, Санкт-Петербург, пр. Металлистов, 3
Scopus Author ID: 6603362644
ORCID: 0000-0002-1388-8649
SPIN-код: 1926-8802
Author ID: 77284
Е. О. Леонтьева
Россия
Леонтьева Екатерина Олеговна — аспирант
195251 Санкт-Петербург, ул. Политехническая, 29
SPIN-код: 3709-2980
Author ID: 1203809
Рецензия
Для цитирования:
Дун С., Шилин М.Б., Леонтьева Е.О. Развитие новых технологий защиты рыб от инфекций в условиях аквакультуры. Арктика и инновации. 2024;2(3):64-82. https://doi.org/10.21443/3034-1434-2024-2-3-64-82
For citation:
Dong X., Shilin M.B., Leonteva E.O. Development of improved technologies for protecting fish from infections in aquaculture. Arctic and Innovations. 2024;2(3):64-82. (In Russ.) https://doi.org/10.21443/3034-1434-2024-2-3-64-82














